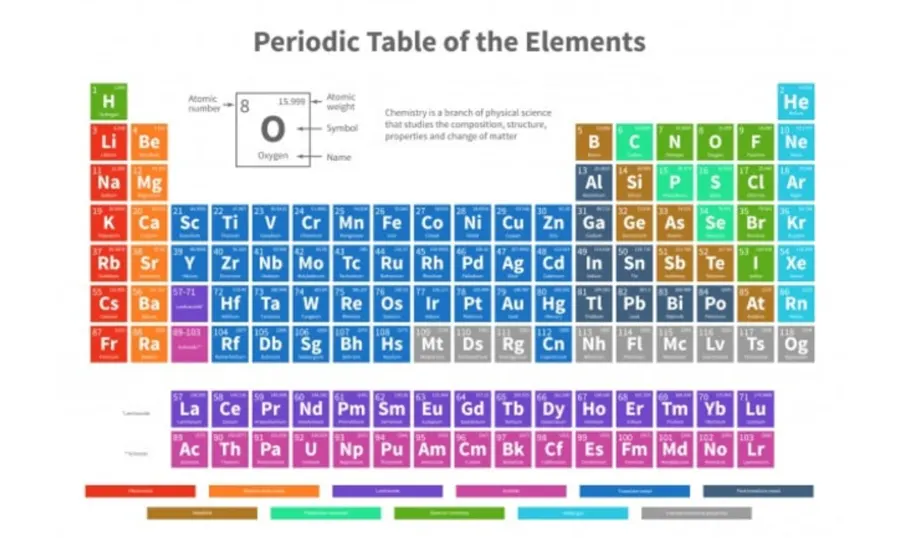
Tabel Periodik Unsur Kimia dan Keterangan Paling Lengkap
Tabel Periodik Unsur Kimia atau sistem periodik merupakan salah satu bagian penting. Hal ini karena menampilkan berbagai macam unsur yang ada.
Pada tabel ini sebenarnya juga ada banyak informasi penting mengenai setiap unsur. Sehingga akan sangat berguna dalam memahami berbagai bahan kimia.
Mengenal Tabel Periodik Unsur Kimia
Unsur-unsur yang sudah ada di sistem periodik disusun berdasarkan dengan kenaikan nomor atomnya dan menyerupai sesuai sifatnya. Bagaimana sistem periodik unsur bisa terbentuk, cara membaca dan kecenderungan sifat keperiodikan unsur akan dibahas dalam ulasan.
Untuk sampai ke bentuk sistem periodik yang saat ini digunakan, sebenarnya sejarahnya terbilang cukup panjang. Bahkan, sudah mengalami beberapa kali perubahan.
Selain karena jumlah unsur yang telah ditemukan pada masanya belum lengkap. Bahkan, ada keterbatasan teknologi dan informasi juga menjadi kendalanya.
Perkembangan sistem periodik ini dimulai lebih dari 200 tahun yang lalu dan terus berkembang beberapa kali sampai ke bentuk yang saat ini digunakan. Berikut ini sudah ada beberapa sejarah perkembangan Tabel Periodik Unsur Kimia dari pertama hingga terbaru.
1. Tabel Periodik oleh Antoine Lavoisier
Seorang ilmuwan kimia yang berasal Prancis bernama Antoine Laurent Lavoisier telah menjadi tokoh pertama yang mengembangkan sistem periodik pada tahun 1789. Di masa tersebut hanya ada sedikit unsur yang ditemukan.
Bahkan, ilmuwan ini dipublikasikan olehnya namun merupakan penemuan yang sangat penting. Unsur-unsur yang saat itu ditemukan hanya dikelompokkan berdasarkan pembagian sifatnya.
Misalnya saja logam, nonlogam, gas serta juga tanah. Tabel Periodik Unsur Kimia ini sebenarnya banyak pilihannya.
2. Tabel Periodik Dobereiner
Berikutnya pada tahun 1829 ada seorang ahli kimia dari Jerman yakni Johann Wolfgang Dobereiner. Ia telah membuat sistem periodik untuk menyempurnakan yang telah ditemukan oleh Lavoisier.
Dimana menjadi dasar penyusunan tabel periodik Dobereiner yaitu massa atomnya. Dobereiner telah mengelompokkan tiga unsur dalam satu kelompok dengan aturan Triad atau Triade.
Pada aturan ini, massa atom unsur pertama dijumlahkan dengan massa atom unsur ketiga. Setelah itu, unsur kedua akan mempunyai massa atom rata-rata dari unsur pertama dan ketiga.
3. Tabel Periodik oleh John Newlands
Sistem Tabel Periodik Unsur Kimia selanjutnya telah dilanggar lagi oleh kimiawan dari Inggris bernama John Newlands. Newlands ini telah berhasil mengelompokkan unsur-unsur berdasarkan kenaikan massa atomnya dengan sistem oktaf.
Menurut pendapatnya, sifat kimia dan fisik dari unsur akan langsung berulang pada urutan ke delapan. Hal ini berarti, unsur ke delapan akan memiliki sifat yang hampir mirip dengan unsur pertama layaknya oktaf.
Misalnya saja seperti musik yang pada nada ke 8 akan kembali ke “do”. Ada beberapa tabel pengelompokan unsur berdasarkan aturan oktaf dari Newlands.
4. Sistem Periodik Dmitri Mendeleev
Berikutnya pada tahun 1871, seorang ahli kimia yang berasal dari Rusia. Ia bernama Dmitri Mendeleev telah menyempurnakan sistem Tabel Periodik Unsur Kimia sebelumnya.
Mendeleev sudah lama berhasil mengelompokkan unsur-unsur. Dimana sudah memiliki sifat yang mirip ke dalam satu kolom yang dikenal sebagai golongan.
Setelah itu, unsur-unsur telah diurutkan berdasarkan kenaikan massa atom relatif dalam satu baris. Ini biasanya disebut dengan periode.
Di tabel yang telah dibuat olehnya, tersisa beberapa celah kosong yang sangat diyakini akan menjadi tempat unsur. Dimana belum ditemukan pada saat itu.
Sistem yang telah dibuat Mendeleev ini juga menjadi dasar sistem periodik modern. Sehingga dikenal sebagai seorang penemu sistem periodik dari unsur kimia. Ada beberapa sistem pengelompokan unsur berdasarkan aturan dari Mendeleev.
Mengenal Sistem Periodik Henry Moseley
Setelah ada berbagai penemuan sains sampai akhirnya ditemukan partikel penyusun atom. Misalnya seperti elektron, proton, dan neutron, akhirnya sistem periodik juga ikut berkembang.
Adalah Henry Moseley yang selanjutnya akan menyempurnakan sistem Tabel Periodik Unsur Kimia dari Mendeleev pada tahun 1914. Moseley kemudian telah menemukan bahwa nomor atom termasuk jumlah dari partikel positif yang ada di dalam sebuah atom.
Aturan mengenai nomor atom ini yang kemudian dijadikan dasar dalam pengelompokan unsur di sistem periodik. Sehingga sampai saat ini baru dan berlaku.
Setelah semakin banyaknya unsur yang ditemukan di alam, kemudian pada akhirnya sistem Tabel Periodik Unsur Kimia sudah disusun oleh Moseley menjadi lengkap. Bahkan, menjadi salah satu tabel periodik yang digunakan hingga saat ini.
Cara Baca Tabel Periodik Unsur Kimia
Pada sistem periodik yang telah digunakan saat ini, unsur-unsur disusun berdasarkan kenaikan nomor atomnya secara horizontal. Selain itu, juga berdasarkan sifatnya secara vertikal.
Bentuk tabelnya sebenarnya tidak merata karena memang disesuaikan sesempurna mungkin. Hal ini tentunya untuk mengelompokkannya dengan baik.
Agar bisa langsung membaca sistem periodik, ada dua hal dasar yang perlu dipahami. Misalnya saja seperti yang disebut dengan golongan dan periode.
Golongan termasuk salah satu pengelompokan unsur dalam satu kolom (vertikal). Sedangkan, periode termasuk kelompok unsur dalam satu baris (horizontal).
1. Golongan dalam Sistem Periodik Unsur
Unsur-unsur yang saat ini berada dalam satu kolom (vertikal). Ini sama artinya berada dalam satu golongan yang sama.
Ada 2 golongan dalam sistem periodik yakni golongan A yang merupakan golongan utama. Selain itu, ada golongan B yang merupakan golongan logam transisi.
Golongan A sudah terbagi atas 8 golongan mulai dari IA hingga VIIIA. Dimana sudah ada dalam tabel terpisahkan oleh golongan B di tengahnya.
Jadi setiap golongan sebenarnya mempunyai nama masing-masing dengan kemiripan sifat dari unsur-unsur penyusunnya. Setelah itu, sudah ada golongan B yang dikenal dengan golongan logam transisi yang terletak di antara golongan IIA dan IIIA.
Di dalam Tabel Periodik Unsur Kimia, golongan B paling kiri adalah IIIB. Bahkan akan berlanjut sampai VIIIB yang memiliki 3 kolom.
Setelah itu, akan dilanjutkan dengan golongan IB dan IIB di sebelah kanannya. Letak golongan suatu unsur ini bisa dilihat dari konfigurasi elektron dan atom unsur tersebut dengan mudah.
2. Periode dalam Sistem Periodik Unsur
Periode dikenal sebagai salah satu kelompok unsur dalam satu baris (horizontal). Sehingga Tabel Periodik Unsur Kimia akan langsung tersusun dari unsur dengan kenaikan nomor atom yang teratur.
Ada beberapa periode di dalam sistem periodik yang setiap periodenya mempunyai jumlah unsur yang berbeda. Letak unsurnya sendiri dalam periode di sistem periodik menunjukkan jumlah kulit atau bilangan menemukan utama dari suatu atom unsur.
- Periode 1 hanya terfokus dari 2 unsur
- Periode 2 dan 3 terfokus dari 8 unsur
- Periode 4 dan 5 terfokus dari 18 unsur
- Periode 6 terfokus dari 32 unsur yang diantaranya yaitu unsur deret lantanida yang biasanya ditaruh di bagian bawah tabel.
- Periode 7 terfokus unsur yang belum lengkap dan juga ada deret aktinida yang biasa Letakkan di bawah tabel, serta di bawah deret lantanida.
Letak suatu unsur di dalam sistem Tabel Periodik Unsur Kimia dan konfigurasi elektron sangatlah berkaitan erat. Hal ini karena susunan konfigurasi elektron tersebut yang kemudian bisa dijadikan cara.
Hal ini tentunya untuk menentukan letak dari suatu unsur di sistem periodik. Mulai dari golongan dan juga periode yang telah ditetapkan.
Arti Warna Tabel Periodik Unsur Kimia
Di beberapa Tabel Periodik Unsur Kimia, sudah ada beberapa warna tertentu pada unsur-unsurnya. Secara umum, warna-warna yang ada di sistem periodik telah menunjukkan sifat dari unsur seperti logam, semi-logam dan nonlogam.
Selain itu, sudah ada pula beberapa sistem periodik unsur. Sehingga akan memberi warna berdasarkan wujud dari suatu unsur dalam keadaan bebas.
Tabel Periodik Unsur Kimia dari benda padat, cair dan gas. Akan tetapi, biasanya di sekitar tabel akan disediakan petunjuk terkait arti dari warna yang ada di setiap unsur.
Hubungan Antara Tabel Periodik Sifat Keperiodikan Unsur
Pada unsur-unsur yang sudah ada dalam susunan sistem periodik, terdapat kecenderungan dari beberapa sifat yang dikenal dengan sifat keperiodikan unsur. Berikut ini sudah ada sifat keperiodikan unsur dan hubungannya dengan susunan sistem periodik, antara lain:
1. Sifat Jari-Jari Atom
Jari-jari atom termasuk salah satu jarak antara inti atom ke orbital elektron paling luar dari suatu atom. Jika dilihat dari satu golongan, semakin bawah letak unsur maka akan semakin besar jari-jari atomnya.
Sementaraitu, dalam satu periode, semakin kiri letak unsur dalam sistem periodik. Sehingga Tabel Periodik Unsur Kimia makin besar jari-jari atomnya.
2. Sifat Energi Ionisasi
Energi ionisasi dikenal sebagai salah satu energi yang diperlukan untuk melepas satu elektron terluar dari suatu atom. Dalam satu golongan, unsur yang berada lebih atas sudah mempunyai energi ionisasi yang semakin besar.
Dalam satu periode, unsur yang letaknya lebih kanan maka akan langsung memiliki energi ionisasi lebih besar. Jadi semakin besar nilai energi ionisasi suatu unsur.
Hal ini artinya atom dari unsur tersebut akan lebih sulit. Tabel Periodik Unsur Kimia untuk melepaskan elektron sehingga akan lebih bersifat nonlogam.
3. Sifat Afinitas Elektron
Afinitas elektron ini dikenal sebagai salah satu energi yang dilepaskan saat suatu atom mengikat 1 elektron dan membentuk ion negatif. Jadi semakin kanan letak dari unsur dalam periode yang sama, maka semakin besar afinitas elektronnya.
Sementara itu, semakin atas unsur letak dalam satu golongan maka semakin besar pula afinitas elektronnya. Jadi semakin besar afinitas elektron artinya semakin negatif energi yang dilepas.
Hal ini berarti Tabel Periodik Unsur Kimia tersebut akan lebih mudah untuk mengikat elektron. Sehingga sifat logamnya sendiri semakin kecil.
Memiliki Sifat Keelektronegatifan yang perlu diketahui
Keelektronegatifan ini termasuk salah satu kecenderungan suatu atom untuk menarik pasangan elektron dari atom lain di dalam ikatan kovalen. Jika dilihat dari satu golongan, unsur-unsur memiliki kecenderungan kenaikan keelektronegatifan semakin ke atas.
Sementara itu, dalam satu periode, kecenderungan kenaikan keelektronegatifan. Dimana telah terjadi semakin ke kanan letaknya dalam sistem periodik. Sampai saat ini tabel tersebut sudah dipakai oleh seluruh Masyarakat.
Akan tetapi, perlu diingat bahwa unsur-unsur Gas Mulia atau golongan VIIIA tidak mempunyai keelektronegatifan alias keelektronegatifannya bernilai 0. Tabel periodik sebenarnya sudah mengalami banyak perkembangan dalam sejarahnya.
Terdapat banyak sekali informasi yang bisa didapat dari letak unsur-unsur di dalam sistem periodik. Hal ini sebenarnya berguna untuk memahami berbagai gejala dan sifat dalam suatu unsur maupun senyawa di Tabel Periodik Unsur Kimia.